化疗引起的周围神经病变(CIPN)是化疗的一种严重不良反应,目前治疗选择有限。研究表明,中性粒细胞胞外陷阱(NETs)对CIPN的发病机制至关重要。脂多糖(LPS)和高迁移率族蛋白B1(HMGB1)是NETs形成的重要诱导因子。临床上,研究人员发现CIPN患者血浆中LPS、HMGB1和NETs的含量显著增加,且与疼痛VAS评分呈正相关。这表明LPS/HMGB1/NETs可能在CIPN的发展过程中发挥重要作用。然而,LPS/HMGB1在体内积累的机制尚不清楚。化疗药物如奥沙利铂(L-OHP)能够下调巨噬细胞表面清道夫受体A1(SR-A1)的表达,导致巨噬细胞对LPS/HMGB1的吞噬能力下降,从而促使这些物质在体内积累,诱导NETs形成,最终导致微循环障碍和疼痛。因此,上调SR-A1表达可能是缓解CIPN的有效策略。
岩藻多糖是一种独特的硫酸化水溶性多糖,具有抗炎等多种生物学活性。先前研究表明,岩藻多糖可通过上调SR-A1表达来缓解肥胖相关高血压。但其在CIPN中的作用尚未报道。近期,江苏省药理学会资深会员、南京医科大学刘文涛、胡亮教授等在Journal of Neuroinflammation期刊上发表了题为Fucoidan reduces NET accumulation and alleviates chemotherapy-induced peripheral neuropathy via the gut–blood–DRG axis 的研究论文,该研究探索了岩藻多糖在调节SR-A1表达及缓解CIPN中的作用及其潜在机制,研究表明,岩藻多糖通过上调SR-A1表达,促进巨噬细胞对LPS/HMGB1/NETs的吞噬清除,同时维持肠道菌群稳态,从而缓解CIPN。这一发现为CIPN的治疗提供了新的思路和潜在策略。

研究首先证实了NETs在CIPN发病机制中的关键作用。通过检测化疗前后癌症患者血浆中组蛋白H3(H3Cit,NETs形成的标志物)含量,发现化疗后患者血浆中H3Cit显著增加,且与疼痛VAS评分呈正相关。同时,化疗导致组织因子(TF)在血液中积累,伴随手部血液循环减少。随着化疗周期增加,肢体缺血加剧,基质金属蛋白酶9(MMP9)活性增强,这些都是CIPN的重要病理指标。
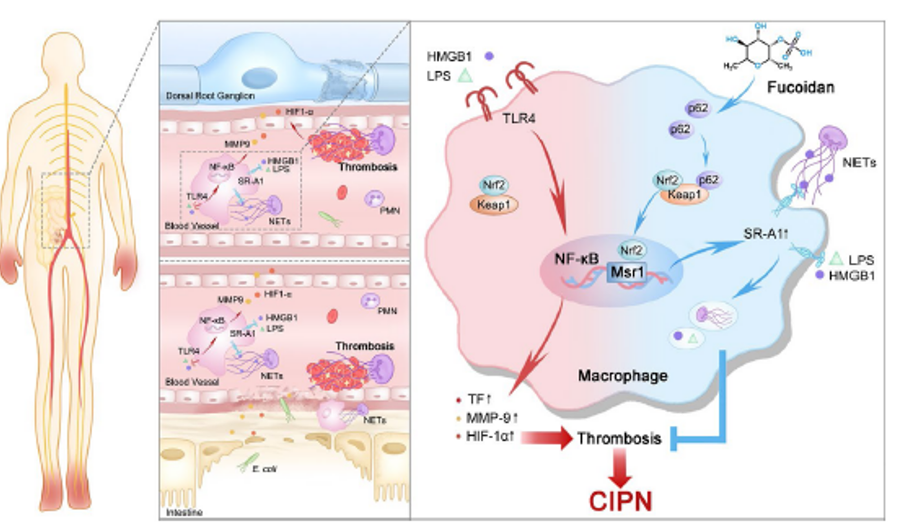
研究进一步发现L-OHP能够显著降低巨噬细胞对LPS/HMGB1的吞噬能力。通过测量巨噬细胞膜上能结合LPS/HMGB1的受体mRNA水平,发现与炎症信号通路相关的TLR4/TLR2等受体表达增加,而清道夫受体SR-A1表达则显著减少。同时,体内实验也证实L-OHP抑制了小鼠肠道和背根神经节(DRG)中SR-A1的表达。SR-A1基因敲除小鼠对低剂量L-OHP更敏感,机械性疼痛更严重,说明SR-A1在CIPN发生中起关键作用。
研究证实岩藻多糖可上调巨噬细胞SR-A1表达,促进对FITC-LPS和FITC-HMGB1的吞噬。体内实验显示,岩藻多糖可缓解L-OHP诱导的机械性痛觉过敏,上调小鼠肠道和DRG中SR-A1受体表达,减少血浆和DRG中LPS积累并降低HMGB1含量,从而抑制NETs形成。此外,岩藻多糖还降低了TF表达,改善了神经末梢和肠道的微循环障碍,最终降低了MMP9活性。这些保护作用在SR-A1基因敲除小鼠中被消除,表明SR-A1在岩藻多糖缓解CIPN中发挥关键作用。
研究发现岩藻多糖不仅能通过上调SR-A1促进巨噬细胞吞噬LPS/HMGB1,抑制NETs形成,还能直接促进巨噬细胞吞噬已形成的NETs。通过活细胞工作站观察,发现未经L-OHP处理的骨髓来源巨噬细胞(BMDMs)能够吞噬培养基中漂浮的NETs,而L-OHP处理后BMDMs吞噬NETs的能力下降。岩藻多糖预处理可改善巨噬细胞的吞噬功能,逆转L-OHP导致的巨噬细胞吞噬功能障碍。SR-A1基因敲除消除了岩藻多糖的这一效应,表明岩藻多糖促进BMDMs吞噬NETs依赖于SR-A1受体。与L-OHP组相比,岩藻多糖显著上调了p62基因表达。p62通过与Keap1竞争性结合,促进Nrf2进入细胞核,最终调控SR-A1的转录。实验证实,岩藻多糖增加了p62的表达,促进p62与Keap1结合,显著增加Nrf2入核,从而上调SR-A1表达。
微生物多样性测序分析(16S)显示,与对照组相比,L-OHP组小鼠粪便中拟杆菌门相对丰度降低,厚壁菌门相对丰度增加,导致拟杆菌/厚壁菌比例降低。岩藻多糖增加了拟杆菌门和疣微菌门的丰度,降低了厚壁菌门和放线菌门的丰度。这表明岩藻多糖可通过调节肠道菌群,维持肠道微生物多样性和稳定性,抑制拟杆菌过度迁移至血液,降低血流中LPS的积累,从而缓解CIPN。
该研究首次揭示了岩藻多糖在CIPN治疗中的潜在应用价值及其作用机制。从机制上看,该研究阐明了岩藻多糖通过p62/Keap1/Nrf2信号通路上调SR-A1表达,促进LPS/HMGB1/NETs清除的分子机制,丰富了对CIPN发病机制的理解。特别是发现SR-A1可能通过识别NETs上的HMGB1来介导巨噬细胞对NETs的吞噬,为理解NETs清除机制提供了新的视角。
江苏省药理学会秘书处朱萱萱
2025.5.15

