新冠肺炎疫情发生后,国家卫健委组织相关专家陆续制定《新冠肺炎诊疗方案》试行版,目前已是“第六版”。关于试行版中新冠肺炎药物如何在短时间应用临床,依据是什么?
我学会资深会员杨劲教授应写意云网络平台的邀请,3月3日晩上20点为680多位企事业单位、科研院所的同仁们作了:“FDA在基于动物有效性试验的应急药物上市路径”网络讲座。
杨教授主要讲了FDA对紧急公共卫生事件应对措施,其中包括四点;1、主要有紧急批准临时新用途,2、紧急开展临床实验,3、同情用药,4、动物法则。
并从科学要求和监管要求解读了药品上市审评要求的各种流程和路径。FDA药品上市审评要求的各种流程一共十五条,其中十一条至十三条是关于临床急需,预防疾病和动物法则在紧急公共卫生事件应对中可以参照的措施,并且杨教授还举了大量的具有说服力的实例。讲座结束后在线的参与人员积极提问热烈。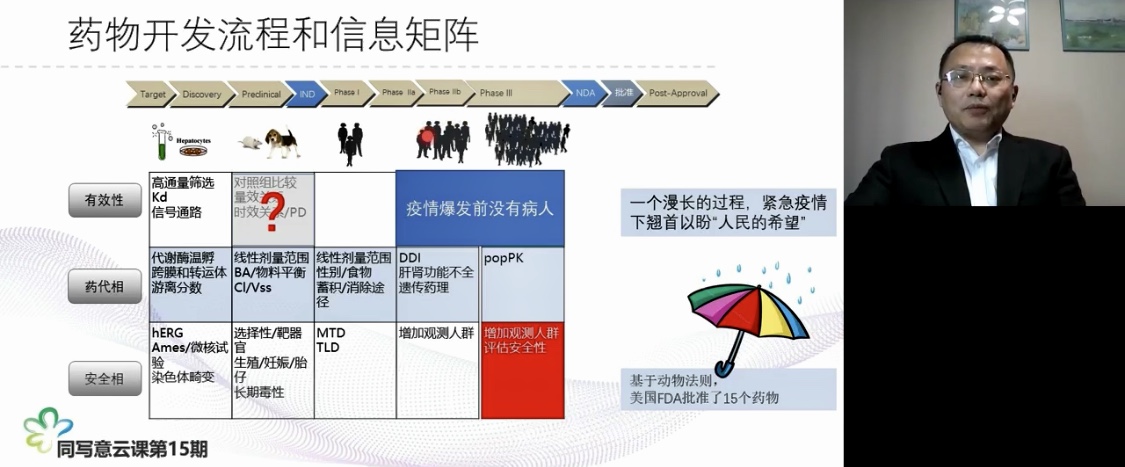
通过杨劲教授的讲座使我们更加了解目前国家卫健委制定《新冠肺炎诊疗方案》 “第六版”药物有效性的研究来源以及FDA在公共卫生突发事件时,应对应急情况下药物上市的审评要求和路途。我学会自新冠肺炎爆发以来已经连续发表多篇关于新冠肺炎重症病人用药的建议,中西医结合治疗用药等报道,引起关注。

