江苏省药理学会
帕金森病是一种常见的神经退行性疾病,主要表现为运动迟缓、静止性震颤、肌肉僵直和姿势平衡障碍。其核心病理机制是大脑黑质多巴胺能神经元逐渐死亡,导致多巴胺水平下降,进而引发运动控制障碍。
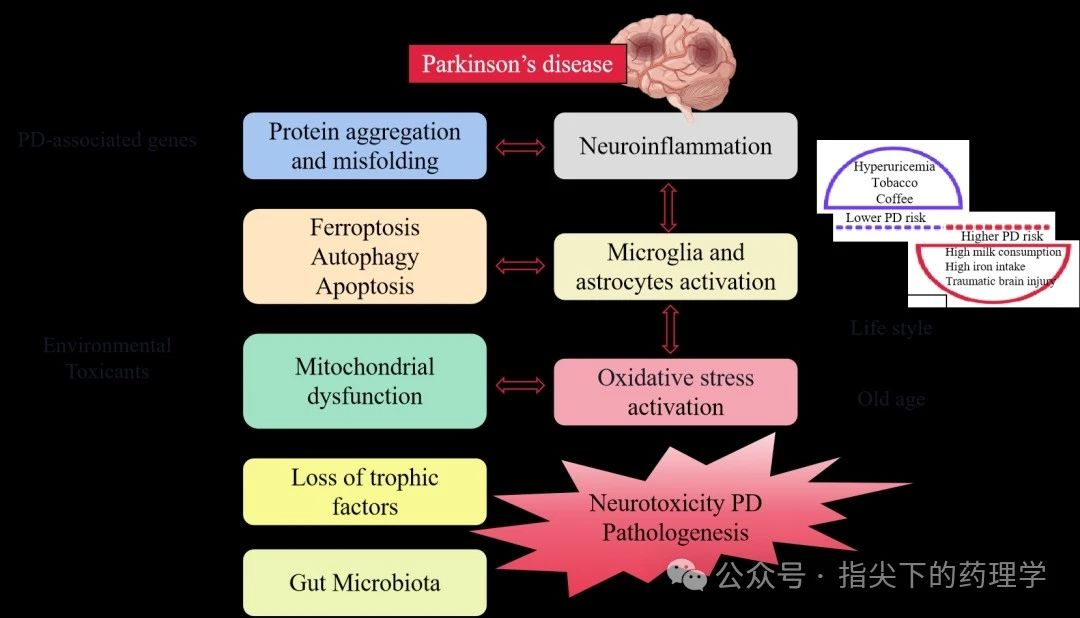
一、帕金森病的病理
1.黑质-纹状体通路损伤 ①黑质致密部多巴胺能神经元变性,导致投射到纹状体的多巴胺减少,破坏DA与ACh的平衡,引发运动症状(静止性震颤、肌强直、运动迟缓等)。 ②病理标志:路易小体(α-突触核蛋白聚集)。 2.其他神经递质异常 5-HT、去甲肾上腺素(NE)、谷氨酸等系统也可能受累,参与非运动症状(抑郁、认知障碍、自主神经功能障碍等)。 3.氧化应激与线粒体功能障碍 多巴胺代谢产生自由基,导致神经元氧化损伤。环境毒素(如MPTP)或遗传因素(如LRRK2、Parkin基因突变)可能加速神经元死亡。
二、帕金森病的典型临床表现
运动障碍 1.静止性震颤:常为首要或最主要症状,表现为静止时有震颤,如手部“搓丸样”抖动、双眼眼皮不自主颤动,安静时明显,活动时减轻。
2.运动迟缓:动作变慢(如穿衣、系扣困难)、步态小碎步、面部表情减少(“面具脸”)。
3.肌强直:肢体僵硬如“齿轮转动”感。
4.平衡障碍:易跌倒、慌张步态。
非运动障碍 1.感觉障碍:早期可能出现嗅觉减退、便秘、睡眠障碍(如夜间大喊大叫)。 2.精神障碍:中晚期常伴抑郁、焦虑、认知功能下降等。 3.自主神经功能障碍:胃肠道症状、直立性低血压、皮脂溢、多汗、膀胱功能障碍、性功能障碍等。
三、 治疗“基石”——左旋多巴
作用机制 1.补充多巴胺:左旋多巴作为多巴胺的前体,可通过口服后在体内的脱羧作用转化为多巴胺,从而补充大脑中的多巴胺水平,改善帕金森病的症状。 2.激动多巴胺受体:左旋多巴不仅可以增加多巴胺的水平,还可以直接激动多巴胺受体,产生类似于多巴胺的生物学效应,有助于缓解帕金森病的运动症状。
3.抑制多巴胺代谢:左旋多巴还能够抑制多巴胺的代谢酶,减少多巴胺的分解,从而延长其作用时间。
4.调节其他神经递质:除了多巴胺,左旋多巴还可能对其他神经递质如去甲肾上腺素和5-羟色胺产生影响,从而改善帕金森病的多种症状。
副作用
1.近期副作用
①胃肠道反应:包括恶心、呕吐、厌食及便秘。
②心血管副作用:可能出现直立性低血压、心律失常。少数患者会出现心慌和心动过速,严重者需要停药。
③睡眠障碍:部分患者会出现睡眠增多或失眠。
④精神症状:少数患者可能出现轻度精神混乱、焦虑不安、妄想或幻觉等。
2.远期副作用
①剂末现象:帕金森病患者在服用左旋多巴类药物后,症状可能会出现节律性的波动。服药初期症状较轻,几小时后症状逐渐加重,直到下一次服药,症状又减轻。这种症状波动会逐渐加重,药物的有效时间会缩短。
②开关现象:患者可能会突然出现运动功能丧失(开关现象),这是由于药物效果逐渐消失所致。
③异动症:包括面部、肢体的不自主运动。
药物相互作用 1.维生素B6:是多巴脱羧酶的辅基,加速左旋多巴转换成DA,降低疗效,增加外周副作用。 2.抗精神病药物:如吩噻嗪类。阻断DA受体,引起锥体外系反应,出现药源性PD,对抗左旋多巴疗效。 3.抗抑郁药:引起直立性低血压,增加左旋多巴副作用。
四、其他类药物
1.多巴胺受体激动剂 普拉克索(Pramipexole)、罗匹尼罗(Ropinirol) 作用:直接激活纹状体D2/D3受体,模拟DA效应。 优势:较少引起运动并发症,可能延缓L-DOPA使用。 副作用:冲动控制障碍、嗜睡、直立性低血压。 2. MAO-B抑制剂 司来吉兰(Selegiline)、雷沙吉兰(Rasagiline) 作用:选择性抑制单胺氧化酶B(MAO-B),减少DA降解,延长其作用时间。 潜在神经保护:可能通过抗氧化或抗凋亡机制延缓疾病进展。 3. COMT抑制剂 恩他卡朋(Entacapone)、托卡朋(Tolcapone) 作用:抑制儿茶酚-O-甲基转移酶(COMT),减少L-DOPA在外周的代谢,增加其生物利用度。 联用L-DOPA:延长疗效,改善“剂末现象”。 4. 抗胆碱药 苯海索(Trihexyphenidyl) 作用:阻断纹状体M受体,纠正DA/ACh失衡,对震颤效果显著。 局限:仅用于年轻患者(老年易致认知障碍、尿潴留)。 5. NMDA受体拮抗剂 金刚烷胺(Amantadine) 作用:拮抗谷氨酸NMDA受体,促进DA释放,改善运动症状(尤其异动症)。 副作用:下肢水肿、幻觉。

