代谢重编程是肿瘤的显著特征之一。即使在氧气供应充足的情况下,肿瘤细胞依然选择将线粒体氧化磷酸化(OXPHOS)转变为有氧糖酵解,以促进细胞增殖,这种现象被称为Warburg效应。越来越多的证据表明,癌基因的激活和抑癌基因的功能缺失突变均可促进代谢向有氧糖酵解转换,提示代谢重编程可能是癌基因和抑癌基因博弈的结果之一。然而,迄今尚不清楚肿瘤中是否存在能阻止代谢重编程且罕见突变的抑癌因子。
2022年2月4日,江苏省药理学会副理事长、南京大学生命科学学院徐强教授团队在Signal Transduction and Targeted Therapy (IF=18.187)上以长文形式发表题为“Intracellular CYTL1, a novel tumor suppressor, stabilizes NDUFV1 to inhibit metabolic reprogramming in breast cancer”的研究论文,提出胞内型CYTL1具有新型抑癌因子特征,其机理系通过稳定NDUFV1抑制乳腺癌代谢重编程。

细胞因子样蛋白1(Cytokine-like 1, CYTL1)是一个小分子量的分泌蛋白,最初在骨髓和脐带血来源的CD34+细胞中被发现。目前已发现分泌型CYTL1发挥多种生物学功能,如调节骨稳态、调控心脏纤维化和促血管生成等。但对于其在细胞内的功能,仍然知之甚少。
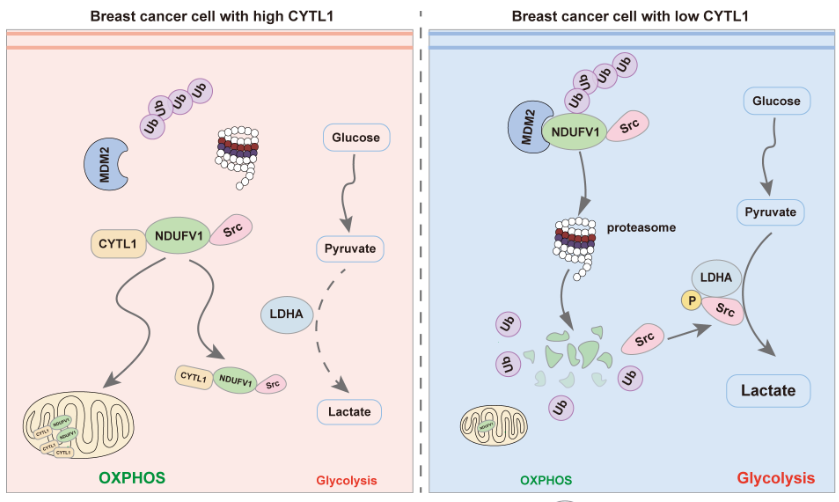
在该研究中,徐强教授团队首先发现了乳腺癌患者组织中低表达的CYTL1水平与胞内型CYTL1的新功能,通过生物信息学分析、葡萄糖吸收、海马检测、乳酸检测等手段,发现乳腺癌中CYTL1低表达是促进代谢向有氧糖酵解转变所必需的。进一步证明,乳腺癌细胞中CYTL1的低表达不受DNA甲基化调控,而是细胞主动控制其分泌的结果,提示乳腺癌细胞中CYTL1的存在不利于肿瘤细胞的生存。分泌至胞外的CYTL1不再具备影响乳腺癌细胞的代谢重编程的能力,在胞内表达CYTL1则可显著抑制乳腺癌细胞的有氧糖酵解及细胞增殖、迁移,相关结果在乳腺癌原位移植瘤模型中也得到了验证。这些结果表明胞内型CYTL1作为重要的抑癌因子在调控乳腺癌代谢重编程中发挥重要作用。
徐强教授团队对胞内CYTL1调控代谢重编程的作用机制进行了进一步的探究。发现胞内型CYTL1可与MDM2竞争性结合在NDUFV1的1-80结构域,从而干扰NDUFV1的泛素化降解,稳定NDUFV1的水平,实现稳态的OXPHOS代谢。同时,NDUFV1可与Src相互作用抑制LDHA的活性,抑制有氧糖酵解。这一发现提示乳腺癌通过降低胞内CYTL1的水平使其代谢从OXPHOS重编程为糖酵解,从而有利于肿瘤细胞的生存和发展。需要指出的是,与p53等已知的抑癌基因不同,CYTL1迄今未见突变的报道。
因此,该研究揭示了CYTL1具有新型的抑癌因子特征,维持肿瘤代谢稳态的功能。调节细胞内CYTL1的表达及其对NDUFV1蛋白的稳定可能成为乳腺癌治疗的新策略。
江苏省药理学会秘书处孙洋
2022.2.6

