最近,哈佛大学Joslin糖尿病中心的科学家在《自然》上发表文章,发现脂肪组织可以与体内器官进行远距离信号交流,通过分泌小分子影响身体其他部位的基因表达。这类新型细胞间信息通讯方式的揭示,让人们意识到,脂肪组织在调节机体新陈代谢方面所发挥的作用可能要比之前认为的大得多,同时也会糖尿病和肥胖症的治疗提供了新思路。
▲文章通讯作者C. Ronald Kahn教授(图片来源:Joslin糖尿病中心官网)
“这一发现真的十分有趣和令人振奋,”美国国家儿童健康系统(Children’s National Health System)的糖尿病和肥胖症专家Robert Freishtat博士评论道:“科学家们早就知道,肥胖与多种疾病的发生有关,但并不具体了解脂肪组织是如何远距离地影响器官及其功能的。”
之前,脂肪组织已被发现可分泌激素,传送至大脑后调控进食行为。这一研究则提供了一个新的视角——小分子核糖核酸(miRNA)。很多细胞都能产生miRNA,以进行细胞内的基因表达调控。同时,也有一些miRNA会游离到细胞外,以外泌体的形式进入血液循环,进而影响到身体其他部位。这样的某些miRNA被认为与糖尿病、肥胖症、癌症和心血管疾病的发生有关。
为了研究来自脂肪组织的miRNA的功能,研究者以Dicer酶在脂肪组织中被选择性敲除的小鼠为实验对象,Dicer酶在miRNA成熟过程中起着关键作用。与正常小鼠相比,这些小鼠的脂肪组织较少,葡萄糖代谢能力也较弱,同时血液循环中的miRNA含量显著偏低。这说明,进入血液循环的外泌体中的miRNA主要来源于脂肪组织。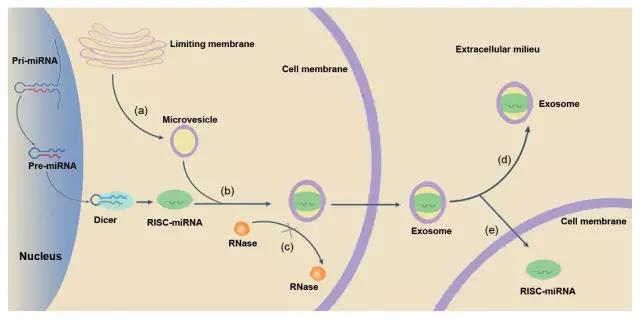
▲miRNA的成熟和进入外泌体(图片来源:《Oncology Reports》)
通过向Dicer缺陷小鼠移植正常的脂肪组织,研究者得以恢复其血液中偏低的miRNA水平以及葡萄糖忍耐性。不过,只有专注于燃烧脂肪以维持体温的褐色脂肪组织具有上述效果,而专注于能量储存的白色脂肪组织则没有。
这些外泌体中的miRNA会对其他器官产生怎样的影响呢?研究人员为此开发出了两组小鼠,以考察源自脂肪组织的miRNA如何在体内进行远距离的信息传递。其中,一组小鼠的褐色脂肪组织可表达人源的miRNA miR-302f,并将其包装于外泌体中,从而进入血液循环;另一组小鼠的肝细胞则表达有miR-302f的作用靶点,后者为mRNA 3′非翻译区(3′UTR)可被miR-302f结合的荧光蛋白。当把第一组小鼠的外泌体注入第二组小鼠的体内后,第二组小鼠肝脏内的荧光信号大大降低。这是因为,前者外泌体中的miR-302f作用于后者荧光报告蛋白的mRNA,使其表达受到抑制。这说明,源自脂肪组织的miRNA可以外泌体的形式,通过血液循环进入肝脏,进而调控肝脏中的基因表达。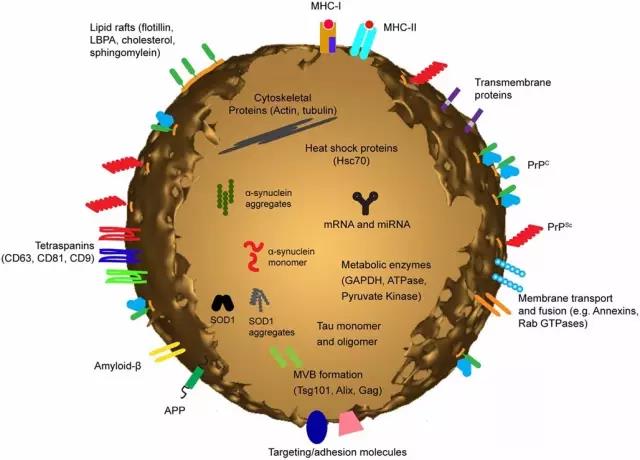
▲外泌体的组成(图片来源:《Frontiers in Physiology》)
类似地,小鼠褐色脂肪组织产生的miRNA miR-99b也会抑制肝细胞中成纤维细胞生长因子21(FGF-21)的表达。当将正常小鼠的褐色脂肪组织或血液中外泌体移植入Dicer缺陷小鼠后,后者肝细胞内的FGF-21表达水平便显著下降。
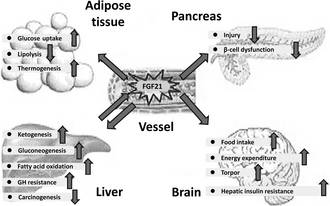
FGF-21是重要的代谢调节激素,被发现可显著改善肥胖小鼠和糖尿病猴的胰岛素敏感性、血糖、血脂、体重等诸多指标,具有成为肥胖症及相关疾病药物的潜质。在肥胖症及其相关疾病(如二型糖尿病、冠心病、非酒精性脂肪肝等)人类患者体内,血液中的FGF-21水平异常偏高,提示着可能存在FGF-21抗性和补偿性反应,显示可能需要超生理剂量的FGF-21注射才能达到治疗效果。
▲FGF-21的代谢调节作用(图片来源:《Clinical Endocrinology》)
“这一发现所揭示的,不仅在于组织间通讯的新途径,而且还有可因疾病状态而改变的信号通路,”文章通讯作者C. Ronald Kahn教授表示。
文章第一作者Thomas Thomou博士还指出,如果能将外泌体工程化改造使其可靶向特定的细胞类型,那么将有望成为有效的药物递送工具。不过,关于外泌体的靶向识别机制,目前尚不清楚。
值得一提的是,该研究还发现,在脂肪营养不良(lipodystrophy)患者的血液中,通常存在着外泌体miRNA水平的异常偏低,与Dicer缺陷小鼠类似。在Robert Freishtat博士看来,这为将小鼠模型与人类患者的研究联系起来提供了一条激动人心的途径。“这一结果十分重要,”Robert Freishtat博士说道:“我们正开始揭开外泌体神秘的面纱,开始了解它们体内调节中的重要角色。”
(本文来源于微信公众号学术经纬)