免疫检查点抑制剂(ICB),尤其是靶向PD-1的抗体,已为部分癌症患者带来长期临床获益,但大多数实体瘤患者的应答率仍偏低,其潜在机制尚未完全明晰。近年来研究表明,肠道菌群在调节抗肿瘤免疫和ICB疗效中发挥关键作用。酪氨酸激酶抑制剂(TKIs)作为一类常用的靶向药物,除了直接抑制肿瘤信号通路外,近年来也被发现可通过调控肠道微生态间接影响免疫治疗应答

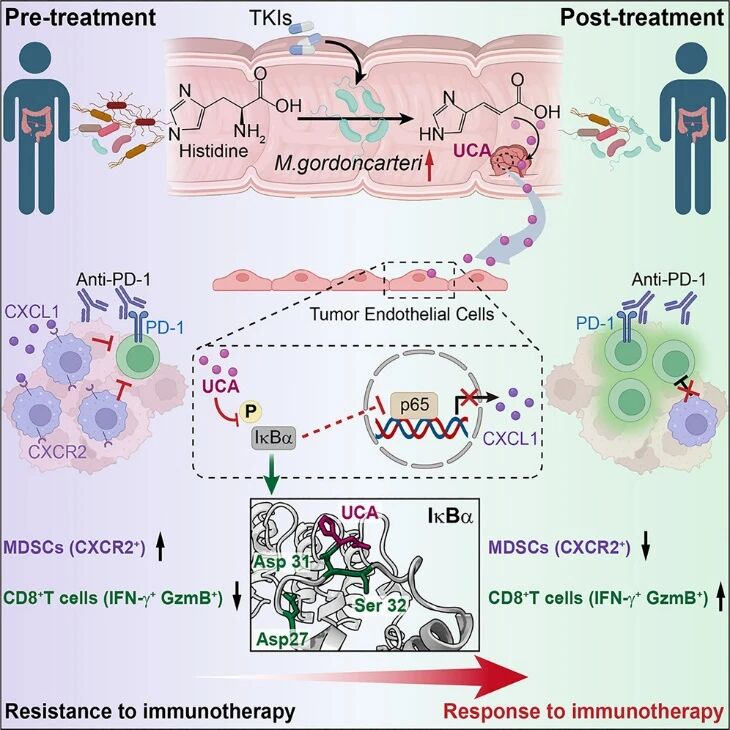
近期,我学会理事长、中国药科大学王广基院士团队在Cell Host&Microbe杂志上发表题目为“Microbiota-derived urocanic acid triggered by tyrosine kinase inhibitors potentiates cancer immunotherapy efficacy”的文章。该研究聚焦于TKI诱导的肠道微生物代谢产物——尿苯甲酸(UCA)在结直肠癌免疫治疗中的功能机制。研究通过多个小鼠模型和分子实验系统揭示,UCA由肠道共生菌 Muribaculum gordoncarteri 合成,并通过共价修饰IκBα、抑制NF-κB信号通路,减少肿瘤微环境中MDSC的募集,从而显著增强抗PD-1疗效。此外,研究还提出UCA及其产菌M. gordoncarteri 有望成为预测ICB疗效的生物标志物,为肠道菌群-肿瘤免疫治疗研究提供了新视角与干预策略。
王广基院士团队的研究揭示了一条关键的肠道菌群–肿瘤轴:TKI诱导Muribaculum产生UCA,后者通过共价修饰IκBα并抑制其Ser32位点磷酸化,阻断NF-κB信号通路,从而抑制CXCL1表达与MDSC募集,增强抗PD-1免疫治疗效果。UCA及其产菌M. gordoncarteri在多种CRC基因背景下均具抗肿瘤潜力,并可作为免疫治疗应答的潜在预测生物标志物,为TKI与ICB联合治疗提供新机制依据与转化前景。