伊立替康是治疗结直肠癌和肺癌的广谱化疗药物,但其迟发性腹泻严重限制临床疗效。经典理论认为细菌β-葡萄糖醛酸酶(β-GUS)介导的活性代谢物SN-38释放是肠毒性主因,但β-GUS抑制剂临床缓解率有限,提示存在未知机制。近年来肠道菌群代谢物被证实可调控肠上皮稳态,而伊立替康如何影响菌群-宿主代谢互作及其对肠毒性的影响尚未阐明。
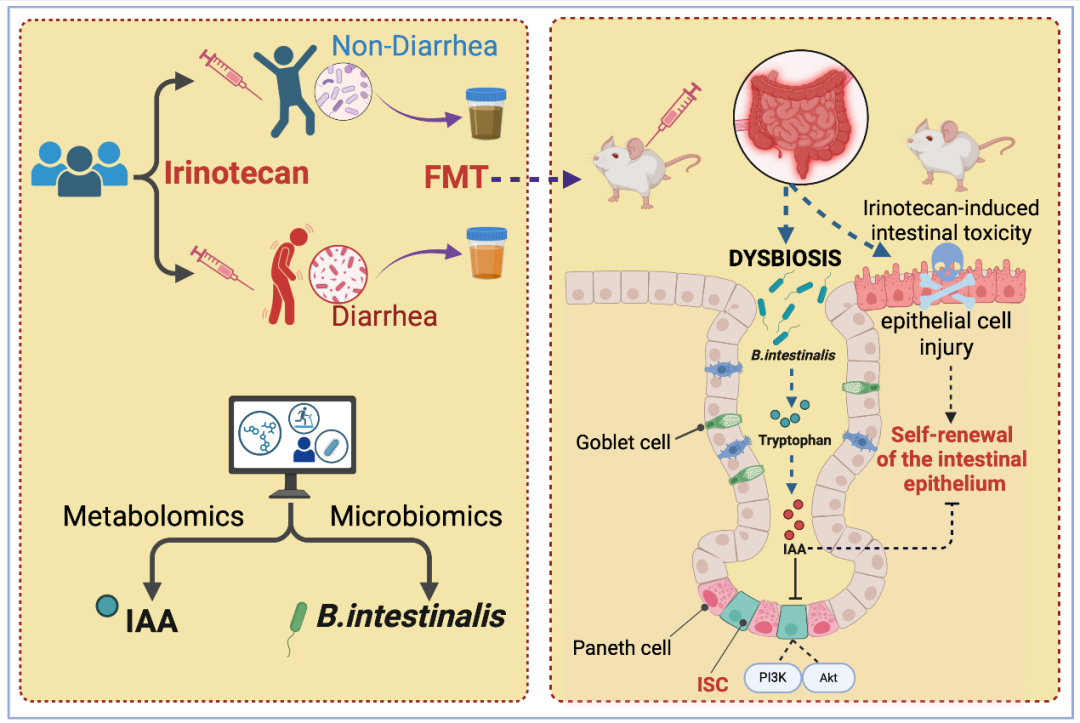
2025年9月3日,我学会副理事长、中国药科大学郝海平/郑啸教授团队联合北京大学第三医院消化科段丽萍教授团队在消化道领域国际期刊Gut发表了题为:Bacteroides intestinalis mediates the sensitivity to irinotecan toxicity via tryptophan catabolites的研究性论文,通过多中心队列分析结合小鼠模型,揭示化疗后富集的Bacteroides intestinalis(B.intestinalis)通过其代谢产物吲哚-3-乙酸(IAA)加剧伊立替康诱导的肠上皮损伤,为其个体化毒性预测提供新策略。

郝海平/郑啸教授等团队前瞻性收集48例接受伊立替康治疗的结直肠癌患者基线及治疗期粪便样本,通过16S rRNA测序和宏基因组分析发现腹泻患者肠道内拟杆菌属(尤其是B.intestinalis)显著富集,且该差异在治疗后被进一步放大。将患者基线菌群移植至小鼠的实验证实,腹泻易感性可通过菌群传递。机制上,伊立替康促进B. intestinalis扩增,其代谢色氨酸产生的IAA在腹泻患者粪便中明显升高,而其他菌株(如B. uniformis)因缺乏IAA合成能力则无此效应。利用合成生物学手段构建的IAA高产菌株可模拟B. intestinalis对肠毒性的加剧作用。肠类器官实验进一步证明,IAA能增强化疗药物对肠道干细胞的损伤。转录组分析揭示IAA通过抑制PI3K-Akt信号通路,阻碍肠上皮修复能力,而Akt激动剂SC79可逆转IAA对干细胞增殖的抑制作用。在动物实验中,补充IAA显著加重肠道组织病理损伤。值得注意的是,B. intestinalis定植或IAA补充均不影响肠道SN-38浓度,表明其独立于经典的β-GUS-SN38代谢物毒性假说。
郝海平/郑啸教授等研究者建立了首个基于菌群代谢物的伊立替康毒性预测模型:患者基线粪便IAA水平与腹泻严重度呈强正相关,且所有需减量用药的腹泻患者均检出高丰度B. intestinalis。该发现突破传统β-GUS为中心的药物代谢毒性理论,为开发菌群靶向干预策略(如IAA合成抑制剂、噬菌体精准消融)奠定基础。研究团队正开展多中心验证试验,推动粪便IAA作为临床毒性预警标志物。
原文链接:https://gut.bmj.com/content/early/2025/09/02/gutjnl-2024-334699.long
江苏省药理学会秘书处朱萱萱 张迪
2025.9.19